[아시아경제 조강욱 기자]
녹십자
녹십자
006280
|
코스피
증권정보
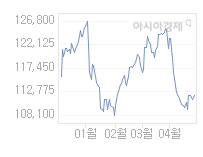 현재가
110,600
전일대비
1,300
등락률
-1.16%
거래량
13,987
전일가
111,900
2024.05.30 15:30 장중(20분지연)
관련기사
GC녹십자, 희소질환 '산필리포증후군' 치료제 美 임상 1상 계획 승인GC녹십자, 희소질환 치료제 FDA에 임상 1상 계획서 제출GC녹십자, '세계 혈우인의 날' 맞아 환아 '소원 성취' 캠페인 진행
close
현재가
110,600
전일대비
1,300
등락률
-1.16%
거래량
13,987
전일가
111,900
2024.05.30 15:30 장중(20분지연)
관련기사
GC녹십자, 희소질환 '산필리포증후군' 치료제 美 임상 1상 계획 승인GC녹십자, 희소질환 치료제 FDA에 임상 1상 계획서 제출GC녹십자, '세계 혈우인의 날' 맞아 환아 '소원 성취' 캠페인 진행
close
는 지난해 11월 미국 식품의약국(FDA)에 제출한 면역글로불린 아이비글로불린-에스엔(IVIG-SN)의 생물학적제제 품목허가 신청서(Biologics License Application)에 대한 '검토완료공문(Complete Response Letter)'을 받았다고 23일 밝혔다.
녹십자에 따르면 이 공문에서 FDA는 녹십자가 제출한 IVIG-SN의 품목허가 관련 자료를 검토한 결과, 제조 공정 관련 자료의 보완이 필요하다고 밝혔다.
하지만, 제품의 유효성 및 안전성에 대한 FDA 측의 문제 제기는 없었다고 회사 측은 설명했다. 이 부분은 녹십자가 FDA의 까다로운 눈높이를 맞췄다는 설명이다.
FDA는 통상적으로 의약품 허가 관련 자료를 1년간 검토한 후 허가를 승인하거나 보완이 필요한 부분만 명시해 '검토완료공문'을 허가 신청자에게 보낸다.
국내외 의약품 허가 과정에서 이처럼 보완사항을 통보받는 경우는 빈번히 발생한다. FDA가 지난해 美 의회에 보고한 자료에 따르면, 최근 10년간 (2005부터 2014년까지) 전체 의약품 품목허가 신청자 가운데 승인 대신 검토완료공문을 받은 비율의 평균치는 51.1%에 달했다. 이 중 절반 정도가 녹십자와 같이 제조 공정 관련 보완사항이 이었고, 나머지는 제품 자체에 대한 유효성과 안전성 이슈가 제기된 경우였다.
IVIG-SN의 미국 품목허가는 승인 전 최종 단계에 들어서게 됐다고 녹십자 측은 밝혔다. FDA측이 명시한 자료만 보강해 제출하면 최종 승인 조건을 갖추게 되는데다 제조 공정 관련 이슈로 최종 승인을 못 받는 경우가 드물기 때문이라는 설명이다.
허은철 녹십자 사장은 "최종 허가 획득을 위해 해야 할 남은 과정이 매우 뚜렷해졌다"며 "허가 과정을 차질 없이 마무리하는 동시에 미국 현지 판매 및 마케팅 전략을 더욱 공고히 할 것"이라고 말했다.
조강욱 기자 jomarok@asiae.co.kr
<ⓒ투자가를 위한 경제콘텐츠 플랫폼, 아시아경제(www.asiae.co.kr) 무단전재 배포금지>





















![[시시비비]하이브·엔씨소프트 주목한 UAE 대통령](https://cwcontent.asiae.co.kr/asiaresize/269/2024053008323041357A.jpg)
![[최지혜의 트렌드2024]스토리는 맛있다…펀 다이닝의 세계](https://cwcontent.asiae.co.kr/asiaresize/269/2024053010560862458A.jpg)
![[초동시각]인구 회복, '진짜 1등급' 가능하려면](https://cwcontent.asiae.co.kr/asiaresize/269/2024053010360641972A.jpg)
![[포토] 북한탄도미사일 발사](https://cwcontent.asiae.co.kr/asiaresize/113/2024053008491189543_1717026551.jpg)





![[이미지 다이어리] '예스키즈존도 어린이에겐 울타리'](https://cwcontent.asiae.co.kr/asiaresize/113/2024052917032389151_1716969803.jpg)
![[포토] 시트지로 가린 창문 속 노인의 외침 '지금의 나는 미래의 너다'](https://cwcontent.asiae.co.kr/asiaresize/276/2024052913225588618_1716956574.jpg)
![[포토] 수채화 같은 맑은 하늘](https://cwcontent.asiae.co.kr/asiaresize/276/2024052814342187134_1716874461.jpg)



![[뉴스속 용어]한-UAE 'CEPA' 체결, FTA와 차이점은?](https://cwcontent.asiae.co.kr/asiaresize/113/2024052915593788994_1716965977.jpg)
![[뉴스속 용어]'거대언어모델(LLM)' 개발에 속도내는 엔씨소프트](https://cwcontent.asiae.co.kr/asiaresize/276/2022032415383891705_1648103918.jpg)
![[뉴스속 용어]급발진 재연 시험 결과 '사고기록장치' 신뢰성 의문?](https://cwcontent.asiae.co.kr/asiaresize/276/2024042208272146743_1713742041.jpg)
 가장 많이 읽힌 뉴스를 제공합니다. 집계 기준에 따라 최대 3일 전 기사까지 제공될 수 있습니다.
가장 많이 읽힌 뉴스를 제공합니다. 집계 기준에 따라 최대 3일 전 기사까지 제공될 수 있습니다.